AstraZeneca interrumpe sus ensayos de la vacuna de Oxford por una reacción adversa de un voluntario
- España adquirió el pasado agosto 30 millones de dosis de las 300 unidades que la UE obtuvo para los países miembros
- Coronavirus: última hora en directo| Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
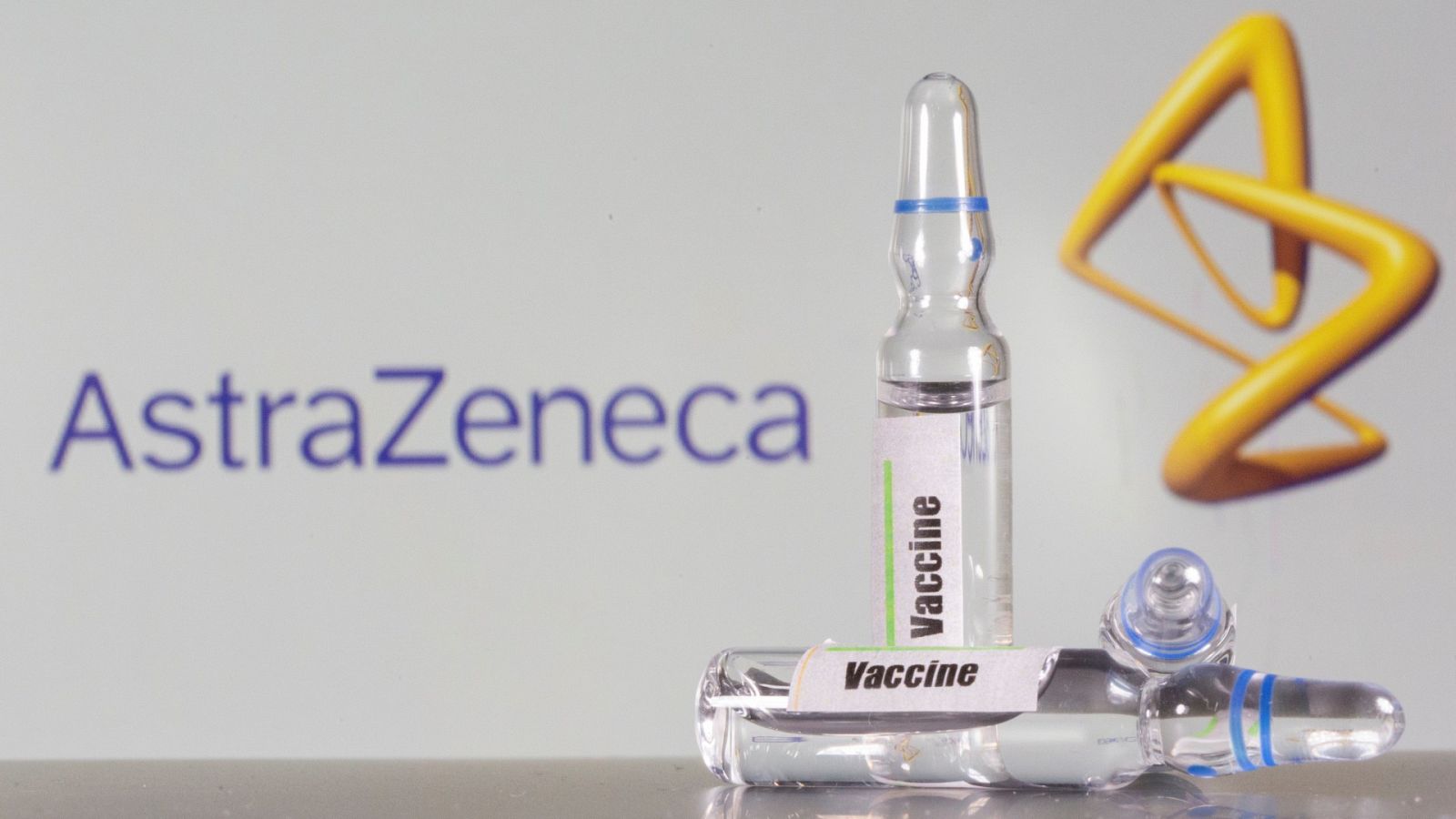
La farmacéutica AstraZeneca ha decidido interrumpir un ensayo clínico para lograr una vacuna contra la COVID-19, porque uno de los participantes sufre "una enfermedad potencialmente sin explicación", según ha informado un portavoz de la compañía a medios de comunicación estadounidenses.
"Esta es una acción de rutina que sucede siempre que hay una enfermedad potencialmente sin explicación en uno de los ensayos mientras se investiga, asegurándonos de que se mantiene la integridad de los estudios", ha señalado el portavoz a la cadena CNBC y el medio especializado Stat.
El voluntario que ha enfermado reside en el Reino Unido, de acuerdo a Stat, que ha asegurado desconocer la naturaleza de la reacción adversa que sufrió el individuo, aunque se espera que se recupere.
Esta es la vacuna que había desarrollado AstraZeneca, con sede en Cambridge (Reino Unido), junto a la Universidad de Oxford y cuya eficacia se estaba experimentando en EE.UU., Brasil y Sudáfrica después de que el ensayo hubiera dado resultados positivos en sus fases iniciales, cuando se probó con mil personas en el Reino Unido.
Debido a su avance, en agosto la Unión Europea (UE) adquirió 300 millones de dosis para repartir entre los países miembros. Esta compra se efectuaría "una vez que la vacuna haya demostrado ser segura y efectiva", según declararon en un comunicado. En el caso de España, había obtenido 30 millones de dosis.
La más prometedora
El portavoz de la farmacéutica, citado por medios locales, ha asegurado que se "está trabajando para acelerar la revisión de ese incidente único con el objetivo de minimizar cualquier impacto potencial en los planes del ensayo".
AstraZeneca había iniciado la fase 3 de su ensayo en EE.UU. a finales de agosto, según clinicaltrials.gov, un registro del Gobierno estadounidense; mientras que en el Reino Unido, Brasil y Sudáfrica, el estudio de la vacuna estaba entre las fases 2 y 3, de acuerdo a Stat.
AstraZeneca tenía previsto tener su vacuna disponible para el primer semestre de 2021 y estaba considerada como una de las más avanzadas del mundo por la Organización Mundial de la Salud (OMS).
Junto a las farmacéuticas Pfizer y Moderna, AstraZeneca es una de las tres compañías que tienen estudios en la fase 3 en Estados Unidos.
Esta es la primera vez que uno de esos ensayos para lograr la vacuna contra la COVID-19 tiene que ponerse en pausa por razones de seguridad.
Confianza de los países en sus resultados
La popularidad de sus positivos resultados ha llevado a los Gobiernos de Argentina y México, así como la fundación mexicana Slim, llegaron en el mes de agosto a un acuerdo con AstraZeneca y con la Universidad de Oxford para fabricar la vacuna en sus países y, luego, distribuirla a todos los países de Latinoamérica, con excepción de Brasil.
Según informó en agosto el presidente de Argentina, Alberto Fernández, el objetivo era elaborar entre 150 y 250 millones de dosis que estarían disponibles a precios accesibles, con un coste individual de entre 3 y 4 dólares.
Por el momento, se desconocen los efectos que podría tener este incidente en los planes de AstraZeneca para desarrollar la vacuna en México y Argentina.