La Agencia Europea de Medicamentos aprueba el uso de la vacuna COVID a partir de los seis meses de edad
- Recomienda el uso de las fórmulas de Pfizer -Comirnaty- y Moderna -Spikevax-
- Se convierten en las primeras vacunas aprobadas para niños menores de cinco años en la Unión Europea
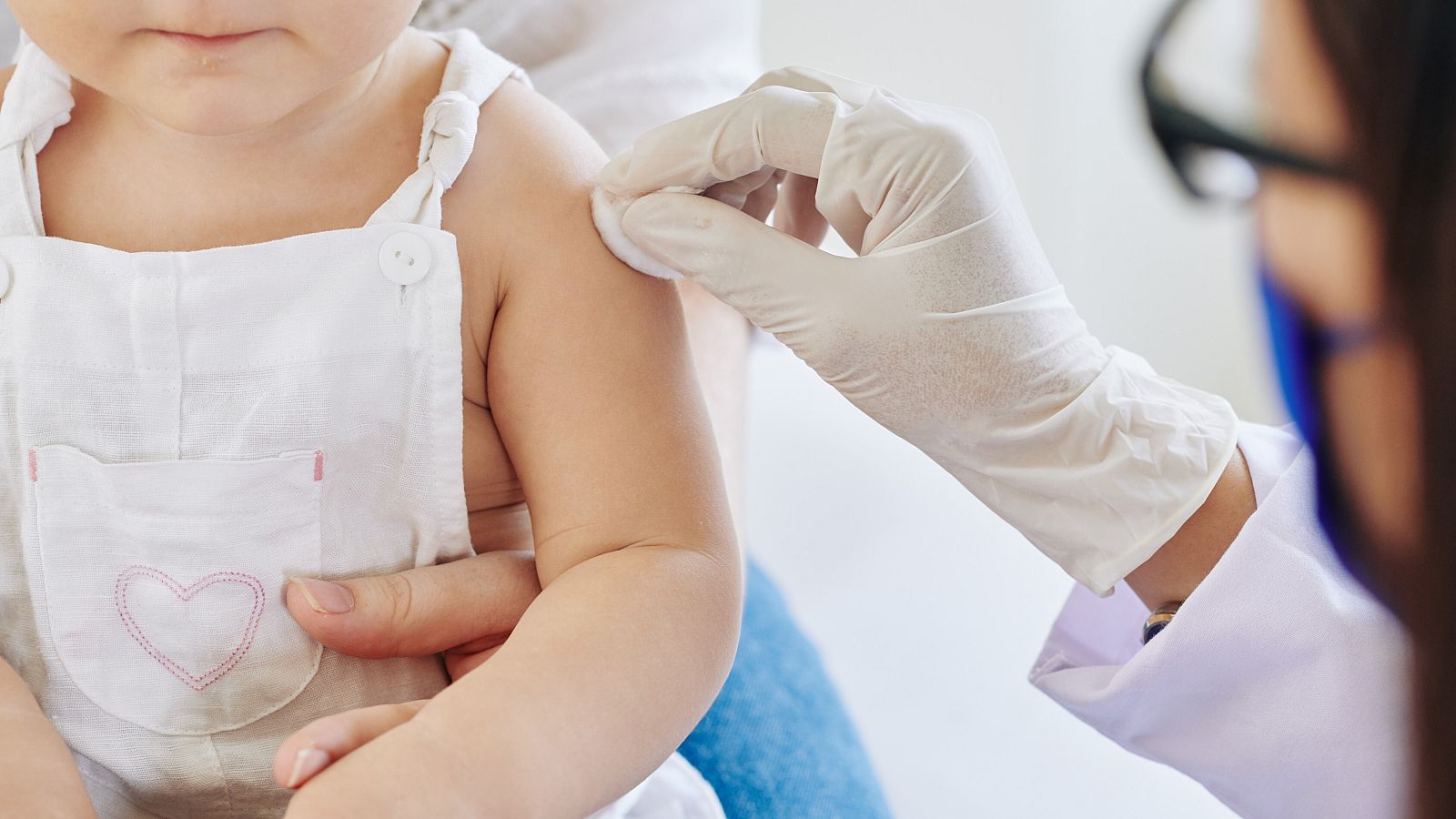

La Agencia Europea de Medicamentos (EMA) ha anunciado que recomienda la aplicación de las vacunas de Pfizer y Moderna contra la COVID-19 para niños mayores de seis meses. El Comité de Medicamentos de Uso Humano (CHMP), dependiente del organismo regulador europeo, ha aprobado el uso en niños de seis meses a cuatro años para la vacuna de Pfizer -cuyo nombre comercial es Comirnaty-, y el uso en niños de seis meses a cinco años para la de Moderna -llamada Spikevax-.
De esta manera, se convierten en las primeras vacunas aprobadas para niños menores de cinco años en la Unión Europea. Comirnaty y Spikevax ya estaban aprobadas tanto en adultos como en niños a partir de cinco y seis años, respectivamente. Ahora, deberán ser las autoridades sanitarias nacionales las que aprueben el uso de las vacunas en estos nuevos grupos de edad.
Según ha anunciado la EMA en un comunicado, las dosis de ambas vacunas en estos nuevos grupos de edad serán menores. En los niños de seis meses a cuatro años de edad, la vacuna de Pfizer puede administrarse en tres dosis de tres microgramos cada una. Las dos primeras dosis se administrarían con un intervalo de tres semanas, seguidas de una tercera dosis al menos ocho semanas después de la segunda.
En los niños de seis meses a cinco años, la vacuna de Moderna puede administrarse en dos dosis de 25 microgramos cada una, con un intervalo de cuatro semanas entre los pinchazos.
Aprobación de la vacuna de Moderna actualizada a BA.4 y BA.5
Además, la EMA ha respaldado la vacuna de Moderna adaptada a las subvariantes BA.4 y BA.5 de ómicron para reforzar la protección contra la COVID-19 en personas mayores de 12 años que ya hayan recibido la pauta primaria. Se trata de la segunda vacuna de Moderna actualizada que aprueba la EMA, después de que el pasado mes de septiembre diese luz verde a la fórmula de esta misma farmacéutica adaptada a la variante BA.1.
“Al igual que todas las vacunas actualmente autorizadas contra la COVID-19, Spikevax sigue siendo eficaz para prevenir enfermedades graves, hospitalizaciones y muertes asociadas con la COVID-19 y se seguirá utilizando dentro de las campañas de vacunación en la UE, en particular para las vacunaciones primarias”, subraya el organismo regulador europeo. La agencia recuerda que la estrategia de la UE es tener una amplia gama de vacunas adaptadas a diferentes variantes de este virus para que los países europeos tengan varias opciones en las campañas de vacunación.